原本應(yīng)該“壽終正寢”的“氧氣快遞員”紅細(xì)胞,卻紛紛意外死亡——溶血性疾病輕則導(dǎo)致疲勞、貧血,重則引發(fā)器官衰竭,原因何在?
針對這一問題,華東理工大學(xué)教授劉琴團(tuán)隊(duì)聯(lián)合空軍軍醫(yī)大學(xué)附屬西京醫(yī)院副教授胡興斌團(tuán)隊(duì),揭示了一種紅細(xì)胞程序性死亡的新機(jī)制。北京時(shí)間4月18日,國際期刊Cell(《細(xì)胞》)以“Red blood cells undergo lytic programmed cell death involving NLRP3”為題,發(fā)表了這一研究成果。

《細(xì)胞》期刊發(fā)表華理聯(lián)合團(tuán)隊(duì)最新成果。 本文圖片均為 華東理工大學(xué) 供圖
該項(xiàng)成果首次揭示補(bǔ)體系統(tǒng)激活觸發(fā)紅細(xì)胞程序性死亡的新機(jī)制——血影蛋白依賴性死亡(spectosis),為溶血性疾病及炎癥性疾病的治療提供了全新藥物靶點(diǎn),不僅有助于人類疾病治療,未來也可拓展至畜禽、水產(chǎn)養(yǎng)殖業(yè)感染性病害防控領(lǐng)域。
作為機(jī)體氧氣運(yùn)輸?shù)暮诵妮d體,紅細(xì)胞負(fù)責(zé)將血液里的氧氣輸送到各個(gè)器官,同時(shí)參與免疫調(diào)控。正常人體內(nèi)的紅細(xì)胞壽命平均為120天,但在病理狀態(tài)下,免疫系統(tǒng)就可能會(huì)錯(cuò)誤識(shí)別紅細(xì)胞,“認(rèn)友為敵”發(fā)起攻擊,激活補(bǔ)體系統(tǒng)這一重要免疫防御機(jī)制,由此產(chǎn)生的膜攻擊復(fù)合物會(huì)在紅細(xì)胞表面“打孔鉆洞”,從而破壞細(xì)胞完整性,最終導(dǎo)致溶血。
研究人員介紹,針對溶血性疾病,當(dāng)前臨床應(yīng)用的補(bǔ)體抑制劑雖然能延緩溶血,但是細(xì)胞破壞過程一旦啟動(dòng),這些抑制劑也將回天乏術(shù),而且單靶點(diǎn)治療效果也受限。因此,解析補(bǔ)體攻擊引發(fā)的紅細(xì)胞內(nèi)部分子事件,開發(fā)針對性干預(yù)策略,成為提升療效的關(guān)鍵突破口。
研究團(tuán)隊(duì)通過構(gòu)建補(bǔ)體激活誘導(dǎo)溶血的體外模型發(fā)現(xiàn),補(bǔ)體信號(hào)的激活會(huì)依次引發(fā)紅細(xì)胞的程序化形態(tài)重塑,并伴隨著細(xì)胞內(nèi)容物的外排等變化。這就提示該過程可能存在程序性死亡機(jī)制。
為了驗(yàn)證這一機(jī)制,團(tuán)隊(duì)進(jìn)一步采用NLRP3和caspase-8特異性激活劑/抑制劑進(jìn)行干預(yù)實(shí)驗(yàn)。研究首次證實(shí),補(bǔ)體激活可觸發(fā)紅細(xì)胞內(nèi)miniNLRP3-ASC-caspase-8信號(hào)通路級聯(lián)反應(yīng),繼而介導(dǎo)下游核心作用靶點(diǎn)血影蛋白β亞基(β-spectrin)的酶切裂解。作為維持細(xì)胞膜骨架的重要組成部分,β-spectrin的酶切降解直接導(dǎo)致膜骨架解體,由此引發(fā)溶血。研究團(tuán)隊(duì)將這一新型程序性死亡方式命名為“spectosis”。
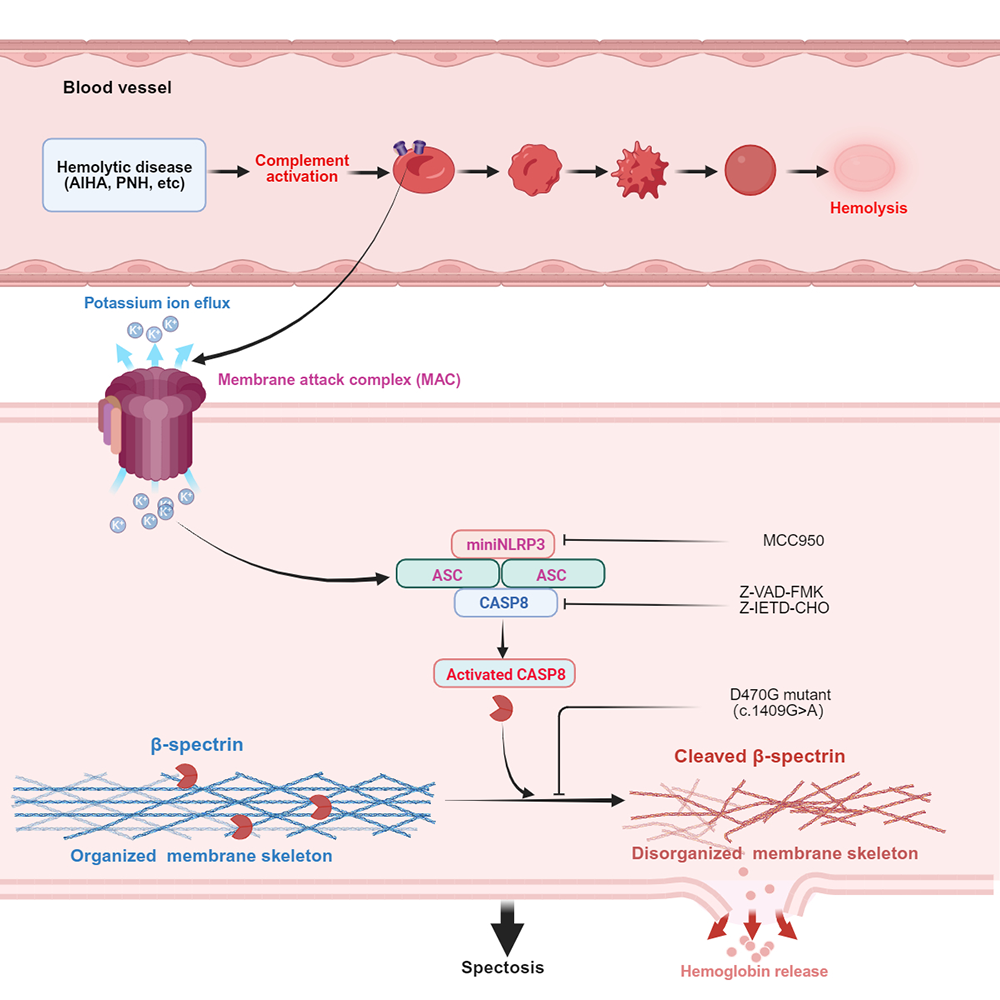
補(bǔ)體信號(hào)途徑介導(dǎo)spectosis的分子機(jī)制
“spectosis定義了一種紅細(xì)胞程序性死亡新機(jī)制,對于溶血性疾病的診斷和治療至關(guān)重要。”劉琴介紹。
科學(xué)構(gòu)想提出后,研究團(tuán)隊(duì)又通過體內(nèi)外機(jī)制進(jìn)行了深度驗(yàn)證。在動(dòng)物實(shí)驗(yàn)中,研究團(tuán)隊(duì)構(gòu)建了急性溶血性輸血反應(yīng)的小鼠模型,成功再現(xiàn)補(bǔ)體依賴性溶血進(jìn)程,相關(guān)實(shí)驗(yàn)從遺傳學(xué)角度驗(yàn)證spectosis的核心機(jī)制。
為了評估spectosis通路關(guān)鍵靶標(biāo)的治療價(jià)值,研究團(tuán)隊(duì)采用補(bǔ)體信號(hào)C3抑制劑和NLRP3炎癥小體抑制劑進(jìn)行干預(yù),發(fā)現(xiàn)兩種藥物聯(lián)合使用“協(xié)同增效”,顯示出“1+1>2”的治療效果。
“這項(xiàng)研究不僅系統(tǒng)闡明spectosis信號(hào)通路的分子機(jī)制,更創(chuàng)新性提出‘補(bǔ)體抑制+細(xì)胞死亡阻斷’的聯(lián)合治療方案。”劉琴教授介紹說,相較于現(xiàn)有單靶點(diǎn)治療,這種“雙管齊下”的策略可突破補(bǔ)體系統(tǒng)代償激活的瓶頸,為溶血性疾病治療開辟有效途徑。
目前,研究團(tuán)隊(duì)已著手建立以紅細(xì)胞spectosis為核心的藥物篩選平臺(tái),首批篩選的藥物分子在養(yǎng)殖魚類感染性腸炎的口服治療中表現(xiàn)出良好效果。“未來,我們將和藥學(xué)專業(yè)教授緊密合作,精準(zhǔn)篩選靶向抑制補(bǔ)體激活及炎癥小體活化的藥物分子,為炎癥性疾病藥物開發(fā)貢獻(xiàn)力量。”劉琴說。
該論文由華東理工大學(xué)生物工程學(xué)院、生物反應(yīng)器工程全國重點(diǎn)實(shí)驗(yàn)室陳守文副研究員、劉琴教授與西京醫(yī)院胡興斌副教授共同指導(dǎo)完成,香港中文大學(xué)(深圳)、上海奧浦邁生物科技股份有限公司提供技術(shù)支持。研究獲國家重點(diǎn)研發(fā)計(jì)劃、國家自然科學(xué)基金等項(xiàng)目資助。(澎湃新聞)





請輸入驗(yàn)證碼