新安晚報 安徽網 大皖新聞訊 不需要去醫院,也不用專業人員輔助,自己在家用類似于“驗孕棒”一樣的試劑盒,就可以自己進行新冠病毒抗原檢測,15分鐘之內就能得到陽性或者陰性的結果。日前,《新冠病毒抗原檢測應用方案(試行)》正式印發,在核酸檢測基礎上,我國增加抗原檢測作為補充,人們開始可以居家自檢,以利于更早更快地“發現”新冠病毒。

新冠病毒抗原檢測試劑。
連日來,全國各地多款抗原自測產品陸續獲批。而作為安徽生物醫藥產業的聚集地,合肥高新區也有多家企業正在向國家藥品監督管理局申請產品注冊上市。

工作人員進行新冠抗原檢測試劑前端層析大板組裝。
自己動手 15分鐘內檢測出結果
3月16日,在位于合肥高新區的必歐瀚生物技術(合肥)有限公司,企業工作人員演示了新冠病毒抗原檢測。
小心地揭開鼻拭子包裝后,工作人員將拭子放入鼻孔,貼鼻腔旋轉四圈后,再放入另一個鼻孔,再旋轉四圈。隨后,將鼻拭子放入帶有試劑的采樣管中,浸泡后,將采樣管里的試劑滴在檢測卡上。經過大約十多分鐘,就可以開始判讀檢測卡,從而得出“陽性”或者“陰性”的結果。

新冠抗原檢測中端,檢測卡自動化裝配。
必歐瀚副總經理王麗說,公司基于在診斷行業的技術積累以及全球化的研發體系,成功研制了新冠檢測系列產品。2020年6月,必歐瀚新冠抗體檢測取得美國FDA-EUA認證和多國注冊,同年又開發了新冠抗原檢測(膠體金法),目前已獲得歐盟CE、澳大利亞TGA等多個國家認證,“我們產品還通過了德國聯邦藥品和醫療器械研究所(BfArM)性能評估,驗證結果顯示產品具有高靈敏度和高特異性,對變異毒株也能檢出。”2021年12月,該產品列入歐盟衛生安全委員會歐盟通用名單(HSC Common List)。

新冠抗原檢測中端,檢測卡自動化裝配。
“我們的抗原產品,在澳洲、歐洲及其他國家銷售達到3000萬測試。”王麗說,必歐瀚也為美國FDA EUA批準的抗原產品代工,“截至目前,由必歐瀚直接出口美國的訂單達到2.5億測試。 ”
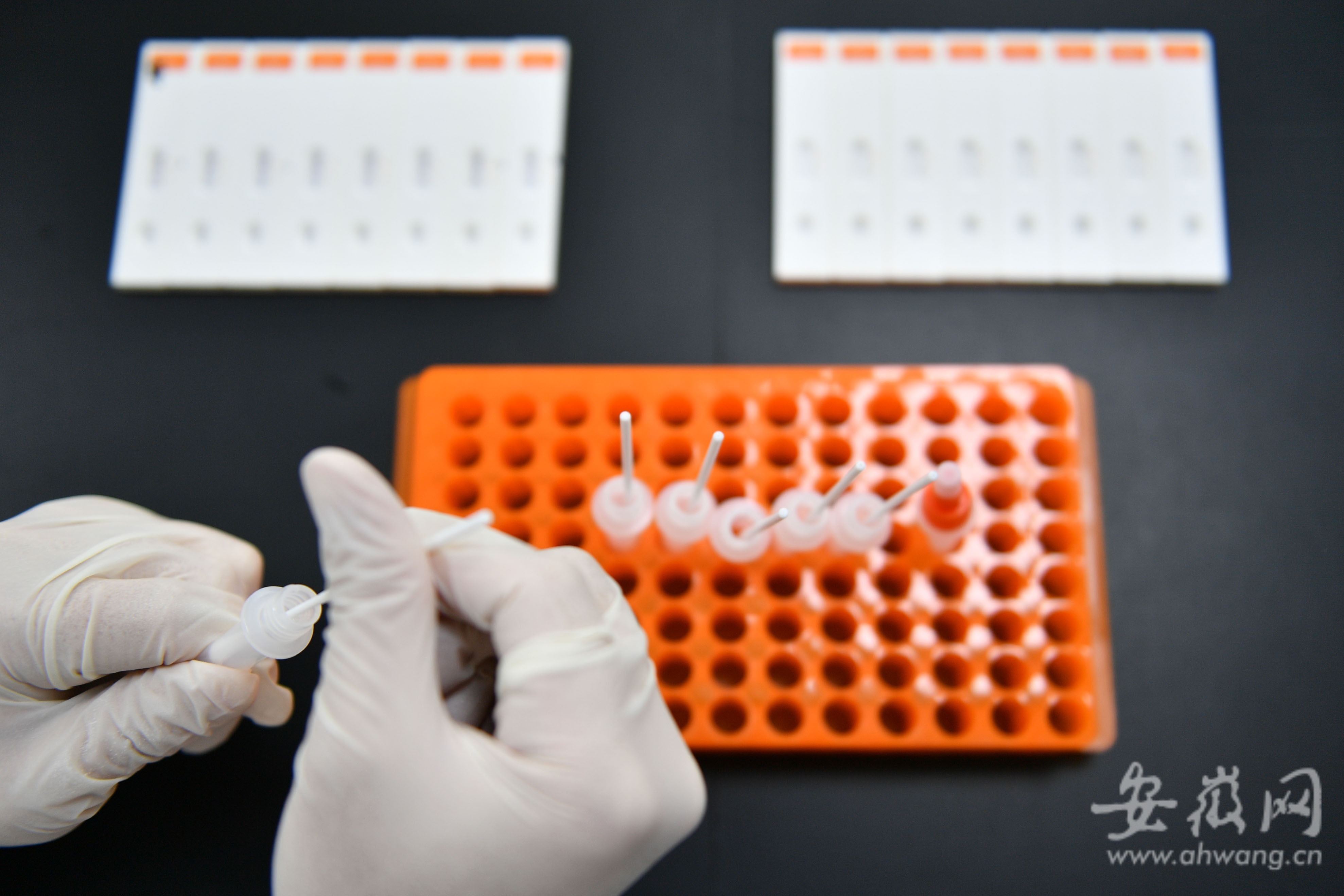
檢測卡性能評估驗證。
國內開始推行抗原檢測后,必歐瀚也開始申請國家藥品監督管理局的注冊,希望能早日在國內上市。據了解,目前必歐瀚車間面積達25000平方米,擁有200條全自動生產線,產能大約 1500萬測試/天,4.5億測試/月。“我們目前產能充足,原輔包材物資準備充分,可生產10億測試。”王麗說。
合肥高新區多家企業申請產品上市
除了必歐瀚,合肥高新區還有多家企業正在申請抗原檢測產品上市。

工作人員進行新冠抗原檢測試劑前端層析大板組裝。
其中,安徽深藍醫療科技股份有限公司自主研發的新冠病毒抗原檢測試劑盒采用膠體金免疫層析法,2020年第一批通過歐盟CE認證,進入商務部出口白名單,并通過了德國、波蘭、西班牙等國家的性能測試。據了解,目前深藍醫療在全球30個國家和機構完成了抗原系列產品的注冊,其抗原系列產品遠銷全球50多個國家,超過2.3億人份。
“我們主要以出口為主,國外訂單比較飽和,目前正在積極申請國內上市注冊證。”深藍醫療有關負責人說,企業目前生產車間總面積達35000平米,最高產能800萬人份/日,產能充足且原輔包材物資準備充分。

操作人員按規定操作壓殼機進行壓殼。
此外,同樣位于合肥高新區的安徽瀚海博興生物技術有限公司、合肥國研漢因檢測科技有限公司等企業,也都研發出自己的抗原檢測產品,并在國外進行廣泛銷售。面對國內市場的打開,兩家企業也都提交了注冊申請。

工作人員對試劑進行包裝。
據了解,目前國家藥品監督管理局正加快批準新冠抗原檢測產品上市的步伐。目前,國家已有十多個產品正式上市。

檢測卡性能評估驗證。
抗原檢測適用這些人群
按照《新冠病毒抗原檢測應用方案(試行)》,抗原檢測適用人群包括:一是到基層醫療衛生機構就診,伴有呼吸道、發熱等癥狀且出現癥狀5天以內的人員;二是隔離觀察人員,包括居家隔離觀察、密接和次密接、入境隔離觀察、封控區和管控區內的人員;三是有抗原自我檢測需求的社區居民。
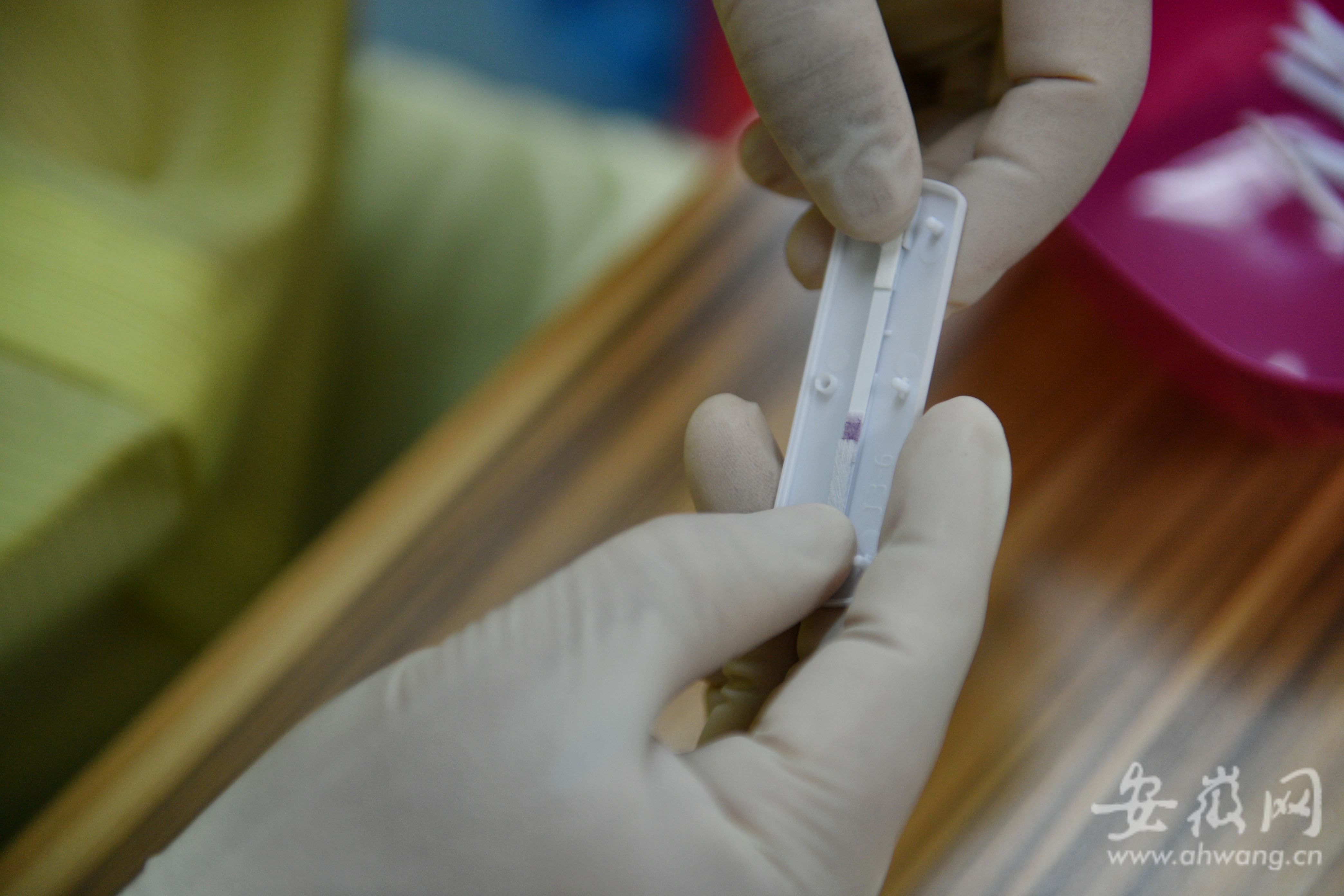
檢測試劑卡條安裝。
根據方案,社區居民有自我檢測需求的,可通過零售藥店、網絡銷售平臺等渠道,自行購買抗原檢測試劑進行自測。

新冠病毒抗原檢測試劑。
居民在家自測抗原,如果陽性要向轄區社區進行報告,社區通知急救中心呼叫120專用救護車輛,把抗原檢測陽性患者閉環轉運到具有核酸檢測條件的醫療機構再進行核酸檢測,如果核酸檢測陽性,然后進入到感染者管理的流程。

試劑成品包裝封口。
國家衛生健康委同時也專門說明,核酸檢測依然是新冠病毒感染的確診依據,抗原檢測作為補充手段可以用于特定人群的篩查,有利于提高“早發現”能力。
葛心怡 新安晚報 安徽網 大皖新聞記者 項磊/文 余康生/圖
編輯 王翠





請輸入驗證碼